Química
COMPUESTOS QUÍMICOS
Son sustancias puras formadas por la combinación de dos o mas especies químicas.

Características:
Óxidos: Un elemento con el Oxigeno.
Hidruros: Metal con el hidrógeno.
Hidrácidos: Hidrógeno con un No metal.
Sal Covalente: No Metal con No Metal.
Sal Metálica: Metal con No metal.
Hidróxidos: Metal con OH.
Oxácidos: Hidrógeno con radical compuesto.
Sales ternarias: Metal con un radical compuesto.
ECUACIONES QUÍMICAS

Las ecuaciones son la representación de los cambios químicos.
ATOMICIDAD:

Pasos:
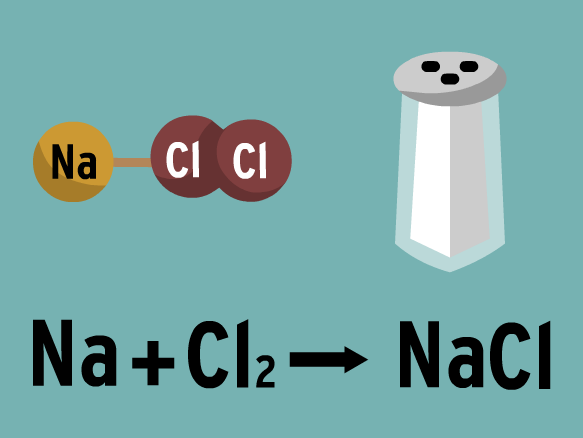
SISTEMA STOCK:

SISTEMA ESTEQUIOMÉTRICO:

-------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Proceso de Disolución
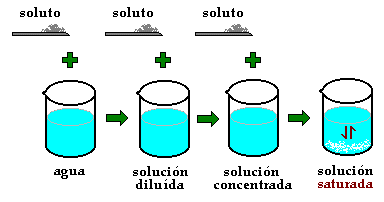
Formas de expresar la concentración de disoluciones
% M/M = g soluto/g solución
% V/V = ml/soluto/ml solución
% M/V =g soluto / ml solución
Molaridad. moles de soluto/ litros de solución
Dato: Agua es el solvente universal.

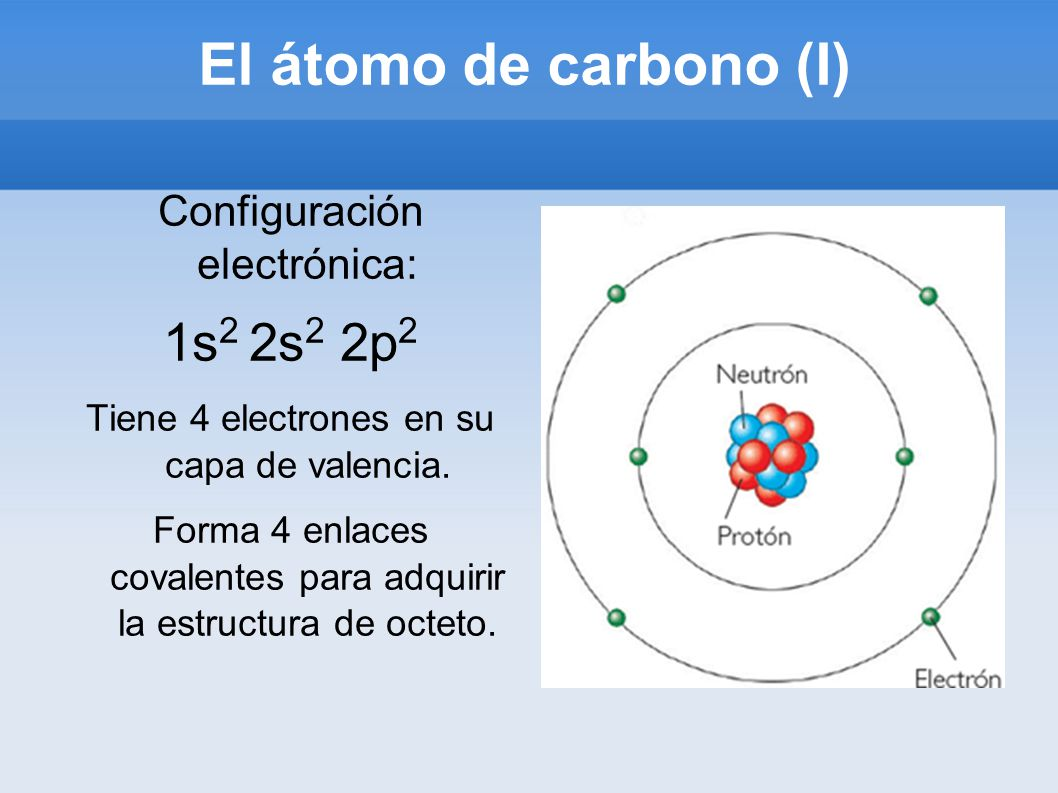
SÍMBOLO: C
NÚMERO ATÓMICO: 6
NÚMERO MÁSICO: 12.O1
DATOS RELEVANTES
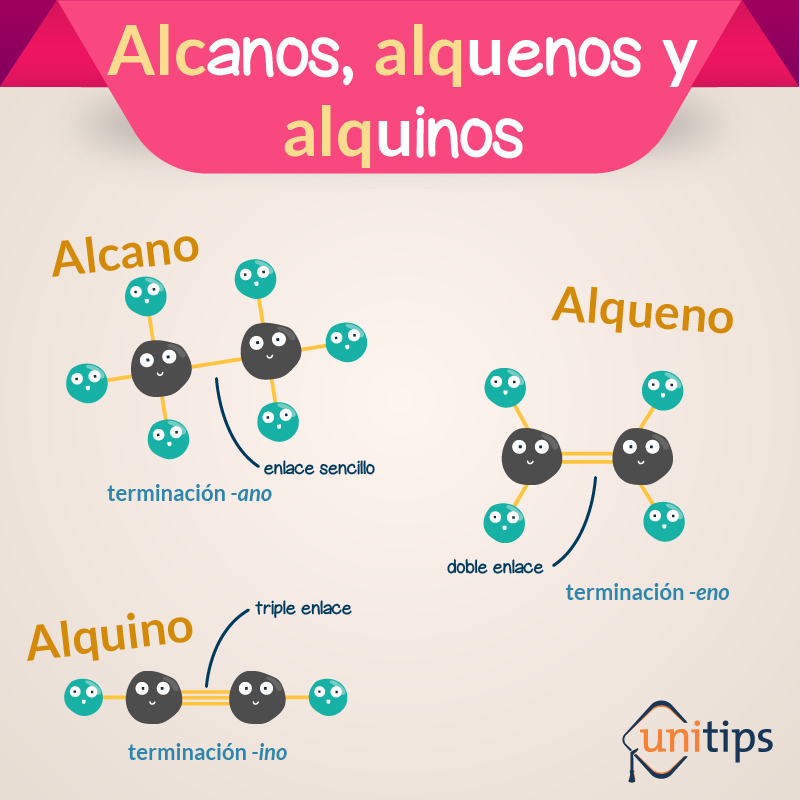
HOMOCOMBINACIÓN: Capacidad de los átomos de Carbono para combinarse entre sí.
Puede ser por medio de:
Simples ----
Dobles ==
Triples
El átomo de Carbono es:

Química Orgánica


Son sustancias puras formadas por la combinación de dos o mas especies químicas.

Características:
- Su composición es fija y constante.
- Se separa por métodos químicos.
- Las propiedades de los componentes que le dieron origen se pierden.
- BINARIOS: Dos elementos diferentes.
Óxidos: Un elemento con el Oxigeno.
Hidruros: Metal con el hidrógeno.
Hidrácidos: Hidrógeno con un No metal.
Sal Covalente: No Metal con No Metal.
Sal Metálica: Metal con No metal.
- TERNARIOS: Tres átomos distintos.
Hidróxidos: Metal con OH.
Oxácidos: Hidrógeno con radical compuesto.
Sales ternarias: Metal con un radical compuesto.
- CUATERNARIOS: Cuatro diferentes elementos.
ECUACIONES QUÍMICAS

Las ecuaciones son la representación de los cambios químicos.
ATOMICIDAD:
- Metales: Monoatómicos.
- H-N-O-F-Cl-Br-I: Biatómicos.
- P-As: Tetraatómicos.

Pasos:
- Escribir correctamente los símbolos.
- Escribir primero el número más electropositivo y seguidamente el más electronegativo.
- Intercambio el número de oxidación.
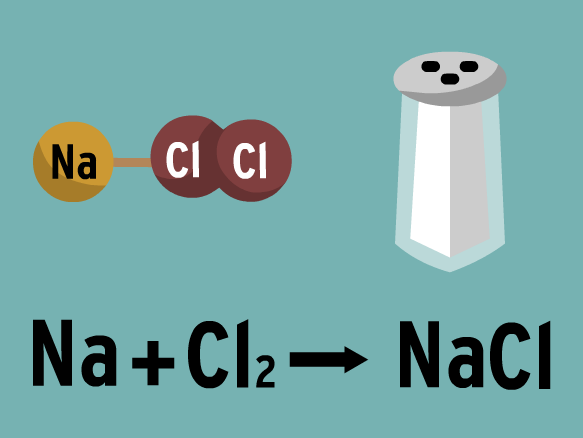
SISTEMA STOCK:

SISTEMA ESTEQUIOMÉTRICO:

-------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Proceso de Disolución
- Solubilidad: Cantidad máxima de una sustancia que se puede disolver en 100 g de agua.
- Solución Saturada: El soluto y el disolvente están en equilibrio.
- Solución Instaurada: El soluto y el disolvente no están en equilibrio
- Solución sobre saturada:Es una solución inestable que presenta más soluto del que puede diluir.
- Presión
- Temperatura
- Agitación
- Grado de división

Formas de expresar la concentración de disoluciones
% M/M = g soluto/g solución
% V/V = ml/soluto/ml solución
% M/V =g soluto / ml solución
Molaridad. moles de soluto/ litros de solución
Dato: Agua es el solvente universal.


SÍMBOLO: C
NÚMERO ATÓMICO: 6
NÚMERO MÁSICO: 12.O1
DATOS RELEVANTES
HOMOCOMBINACIÓN: Capacidad de los átomos de Carbono para combinarse entre sí.
Puede ser por medio de:
- Cadena abierta.
- Cadena abierta. Cadenas cerrada
- Cadenas ramificada
Simples ----
Dobles ==
Triples
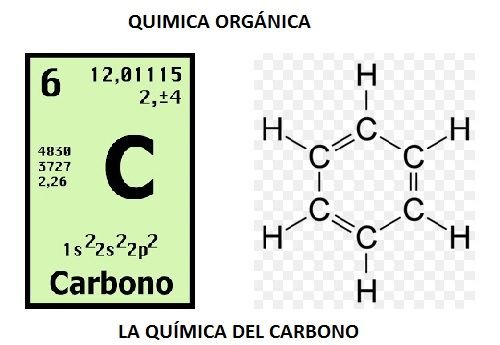
El átomo de Carbono es:
- Tetravalente
- Posee anfoterismo (se une con - y +)
- Puede ser Gráfico o diamante (Alotropría)

Química Orgánica


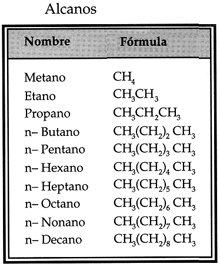
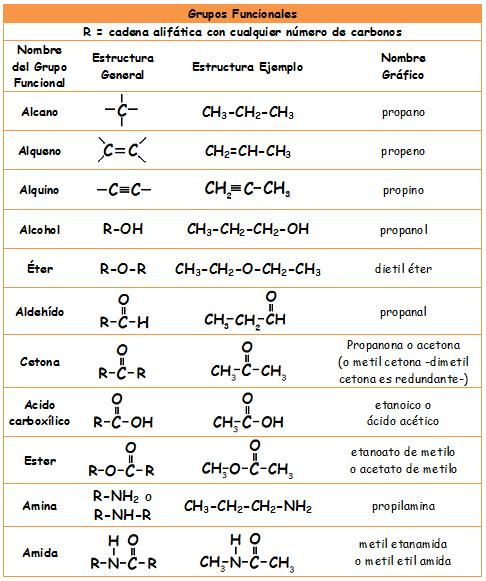
- Alcanos: Enlace simple

- Alquenos: Enlace doble

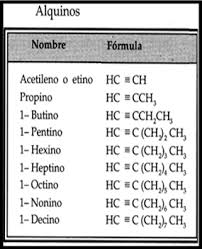
- Alquinos: Enlace triple






